Dinamiche nascoste: le proteine sulla superficie del virus dell’influenza sono sorprendentemente mobili, rivelano nuove analisi. Di conseguenza, la neuraminidasi virale può piegare la sua “testa” di circa 90 gradi e ruotare attorno al proprio asse. D’altra parte, la seconda proteina, l’emoagglutinina, presenta una “respirazione” brusca: la sua estremità tricuspide si apre e si chiude alternativamente. Entrambe le forme di motilità espongono siti di attracco precedentemente non identificati per gli anticorpi e quindi hanno un potenziale medico.
quello virus influenzale È uno degli agenti patogeni di maggior successo di sempre: questo virus a RNA avvolto forma ripetutamente varianti e si adatta a nuovi ospiti. Ciò porta regolarmente alla comparsa di nuovi tipi di influenza che possono infettare gli uccelli o diffondersi all’uomo. I due giocano per la loro capacità di eludere il sistema immunitario e infettare le nostre stesse cellule fuori dalla crosta Le importanti proteine di superficie emoagglutinina (HA) e neuraminidasi (NA) svolgono un ruolo fondamentale.
Il modo in cui queste proteine dell’involucro del virus dell’influenza sono organizzate e disposte è stato ampiamente dimostrato dai virologi utilizzando, tra le altre cose, la microscopia crioelettronica. Tuttavia, fino ad ora, si sapeva poco su come si muovono queste proteine virali e sul ruolo che svolgono nell’infezione, nell’ingresso nelle cellule e nel funzionamento del nostro sistema immunitario.
Un virus composto da 160 milioni di atomi
Questo è esattamente ciò che Lorenzo Casalino dell’Università della California, San Diego, e il suo team hanno ora dimostrato. Sulla base dei dati della microscopia elettronica e delle analisi molecolari dei dettagli delle singole proteine, hanno creato un modello atomico dell’intero virus dell’influenza H1N1, comprese tutte le proteine dell’involucro. Il modello 3D comprendeva più di 160 milioni di atomi e le loro posizioni e legami chimici.
In una simulazione biofisica, i ricercatori hanno quindi determinato come si comportano e si muovono le proteine dell’involucro in condizioni in vivo, ad esempio quando penetrano nelle nostre vie respiratorie e nei tessuti. “Le nostre simulazioni forniscono viste dinamiche senza precedenti dei cambiamenti della morfologia plastica degli attacchi di emoagglutinina e neuraminidasi”, afferma il team.
Neuraminidasi annuì
In effetti, le simulazioni hanno rivelato tre movimenti sorprendentemente dinamici delle proteine dell’involucro virale. Per prima cosa, la proteina neuraminidasi può piegare la sua caratteristica “testa” di oltre 90 gradi. Di conseguenza, la testa dello scoiattolo compie movimenti circolari lungo la gamba. “La piegatura della testa rivela un epitopo precedentemente sconosciuto nella parte inferiore della testa della neuraminidasi”, riferiscono Casalino e colleghi.
La cosa interessante: gli epitopi sono potenziali siti di attracco per gli anticorpi contro le proteine virali. Quindi svolgono un ruolo importante nell’efficacia con cui il sistema immunitario può riconoscere e combattere il virus, ma anche nel modo in cui funzionano i vaccini e i preparati anticorpali. “Abbiamo già identificato un anticorpo monoclonale che può legarsi alla parte inferiore della testa della neuraminidasi”, hanno detto i ricercatori. Questo potrebbe aprire nuove opzioni di trattamento.
La tendenza dell’emoagglutinina rivela “vecchi” siti di attracco.
Lo stesso vale per il secondo movimento proteico identificato nella simulazione. Perché anche la seconda proteina di rivestimento del virus dell’influenza, l’emoagglutinina, può inclinare leggermente la coda. Questa posizione viene mantenuta per un periodo di tempo più lungo e espone immediatamente diversi potenziali punti di attacco: “L’inclinazione graduale del dominio HA esterno ha un profondo effetto sull’accessibilità dei cosiddetti ‘loop vincolanti’ all’estremità inferiore di il gambo proteico”, dicono Casalino e il suo team.
Questi siti di coalescenza profonda sono meno suscettibili alla mutazione e rimangono gli stessi in molti sottotipi di influenza. Di conseguenza, può essere attaccato da anticorpi ampiamente attivi nel corpo o da un preparato. “L’inibizione del dominio esterno dell’emoagglutinina in uno stato obliquo potrebbe migliorare la risposta immunitaria a questi epitopi immobilizzati”, affermano gli autori. In effetti, esistono già molti anticorpi ampiamente neutralizzanti adatti a questi siti di attracco.
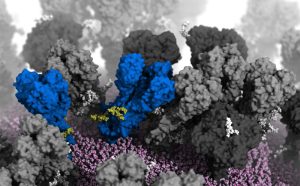
La testa proteica “respira”
Il terzo movimento è ancora più insolito: la proteina emoagglutinina “respira”. L’estremità trilobita di questa proteina dell’involucro si apre e si chiude ciclicamente. “Sembra che le teste proteiche respirino in modo asimmetrico, aprendosi e chiudendosi indipendentemente l’una dall’altra”, dicono Casalino e colleghi. In media, in un dato momento, circa il 70 percento delle proteine HA nel virus dell’influenza sono chiuse e il 30 percento sono aperte.
Analogamente ai movimenti di flessione, la respirazione di questa proteina dell’involucro rende il virus dell’influenza più vulnerabile: quando la testa dell’emoagglutinina si apre, espone un altro potenziale sito di attracco di anticorpi al suo centro. Secondo le simulazioni, questo epitopo è identico a un altro anticorpo ad ampio spettro.
potenziale della medicina
Secondo gli scienziati, queste nuove intuizioni sui movimenti delle proteine dell’involucro dell’influenza sono di grande importanza in medicina. “La flessibilità delle strutture proteiche rivelate nelle nostre simulazioni ci mostra i punti deboli del virus e rivela epitopi che altrimenti sarebbero nascosti o inaccessibili”, spiegano Casalino e colleghi. Questo apre nuove possibilità per attaccare questi siti con anticorpi o vaccini appositamente progettati.
È particolarmente importante che alcuni potenziali siti di attracco rimangano intatti anche quando vengono create nuove varianti influenzali. Ciò potrebbe consentire lo sviluppo di vaccini antinfluenzali e medicinali che non devono essere modificati ogni nuova stagione. (ACS Centrale Scienza, 2023; doi: 10.1021/acscentsci.2c00981)
Fonte: Società chimica americana

“Esperto di birra per tutta la vita. Appassionato di viaggi in generale. Appassionato di social media. Esperto di zombi. Comunicatore.”
